珈创生物 —— 生物技术服务与研发为一体的高新技术企业
优质高效透明
High quality, efficient and transparent
发布时间:2020-01-16 09:59 信息来源: 阅读次数: 次
前言
近年来,DNA 重组技术在医药领域的飞速发展,使得采用哺乳动物细胞表达系统的生物制品药物逐渐成为主流,而对于此技术的主要原材料---细胞系和其他原料的检定要求也日趋严格。

随着质量源于设计(QbD)理念越来越广泛的得到认可,意味着仅仅依靠检测终产品来保证药品质量是远远不够的,这个理念和生物制品一直坚持的全过程质量控制的基本方针是基本一致的。基于这一理念,把控生产用细胞的构建、鉴定,以及细胞库的建立和管理,能够从源头上保证产品质量的稳定。
2015年版《中国药典》三部“生物制品生产用动物细胞制备及检定规程”中,对于生产用细胞基质的质量控制提出了要求。对于生产用细胞,需要建立细胞库,细胞库的建立可为生物制品的生产提供检定合格,质量相同,能持续稳定传代的细胞。在细胞库建立之后,应至少对MCB和生产终末细胞进行一次全面检定。当生产工艺发生改变时,还应重新对生产终末细胞进行全检。细胞检定主要包括以下几个方面:细胞鉴别、外源因子和内源因子的检查、成瘤性/致瘤性检查等。细胞检定的基本要求见下表:
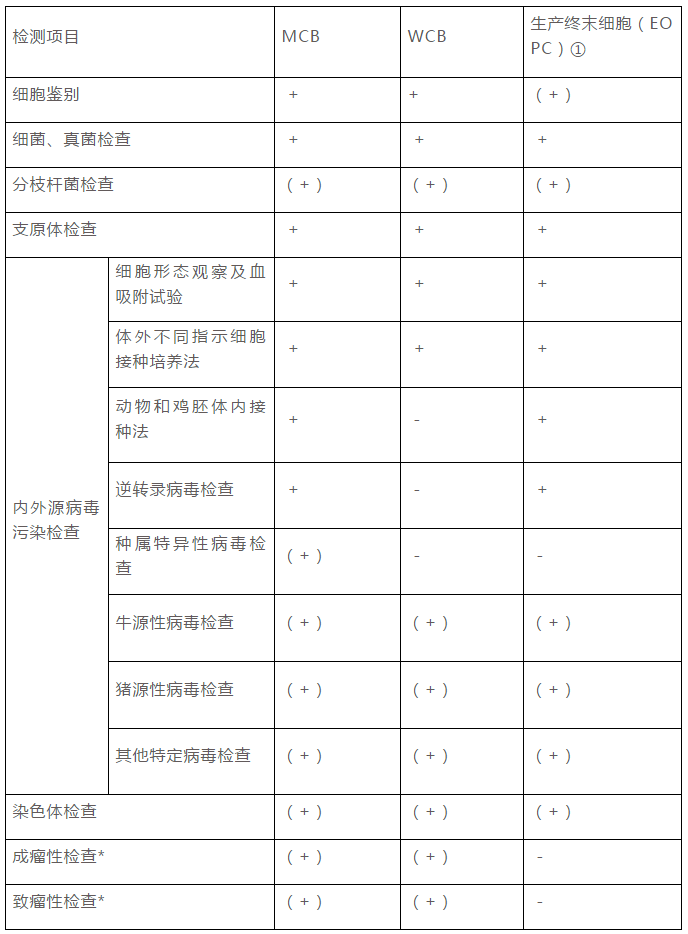

细胞库的检定,对于保证细胞库的质量和为后续工艺提供稳定的合格的细胞尤为必要,此部分的工作对生物制品产品而言非常重要。在进行项目选择时,可参考《中国药典》三部“生物制品生产用动物细胞制备及检定规程”。
大多数生物制品产品是有活性的,无法采用传统的终端灭菌工艺,因此在细胞库建立和生产的各个阶段都需要对无菌性进行检定,其中分枝杆菌的检查是2015年版药典新增项目,检定时应关注。
支原体的污染则是基础研究和工业生产中的常见问题,据报道可能有高达87%的细胞系发生过支原体污染,支原体在光学显微镜下不可见,一般不引起培养物浑浊,因此支原体污染一般很难察觉,支原体检测也十分必要。
感染性病毒颗粒污染生物制品和生物制品衍生产品是被广泛关注的安全问题,对于细胞表达系统可能带来的病毒污染问题世界各国均十分重视,ICH Q5A中规定了相应的技术要求(ICH关于“生物技术产品的病毒安全性评价”)。综合以上因素对于病毒因子的检查应该尽量充分全面。内外源病毒的检定应充分考虑细胞的特性,传代历史,培养过程等因素。例如:
作为单克隆抗体等生物制剂最常用的生产用细胞系,中国仓鼠卵巢细胞(CHO)和小鼠NS0和Sp2/0等细胞系,由于其细胞来源的供体或细胞取材的原因,需要关注其特定种属(鼠源)病毒的检查。
对于细胞建库过程中使用过动物来源的原料:如牛血清,或胰蛋白酶(猪),还需对特定的动物来源的病毒进行检定。

另外,2015版《中国药典》三部的主要变化还有,新增了“人用重组DNA蛋白制品总论”和“单克隆抗体类生物治疗药物总论”这两个总论的制定为生物制品药物的研发和质量控制提供了通用的指导原则。其中“人用重组DNA蛋白制品总论”对于连续培养的生产方式,要求应对收获阶段的微生物污染进行常规检测;“单克隆抗体类生物治疗药物总论”则提出:细胞培养和收获可采用限定细胞传代,单次收获产物的方式;也可采用限定细胞传代时间,连续传代多次收获的方式。而对于两种方式的收获阶段都有相关的规定,每次收获后均应检测抗体含量,细菌内毒素及支原体。对于限定细胞传代次数的生产方式,需要采用适当的体外方法,对3次收获物进行外源病毒的检测。
文章由珈创生物前沿技术研究院提供